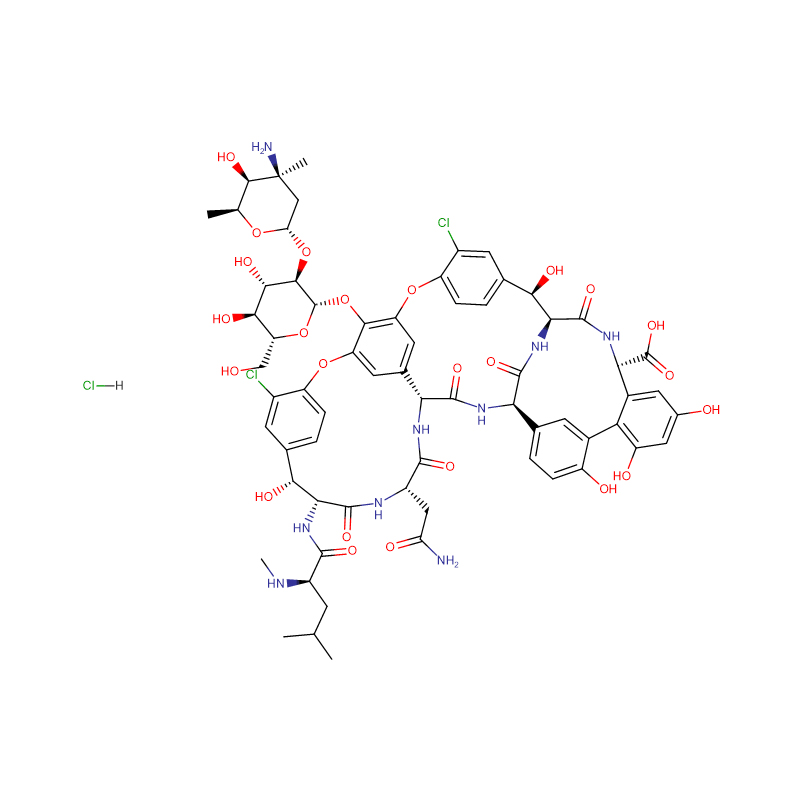
Chlorhydrate de vancomycine Cas : 1404-93-9 Poudre blanche presque blanche ou beige à rose
| Numéro de catalogue | XD90197 |
| Nom du produit | Chlorhydrate de vancomycine |
| CAS | 1404-93-9 |
| Formule moléculaire | C66H76Cl3N9O24 |
| Masse moléculaire | 1485.7145 |
| Détails de stockage | 2 à 8 °C |
| Code tarifaire harmonisé | 29419000 |
Spécification de produit
| Eau | NMT 5,0 % |
| Métaux lourds | NMT 30ppm |
| pH | 2,5 - 4,5 |
| Endotoxines bactériennes | NMT 0,33 UE/mg de vancomycine |
| Clarté de la solution | Clair |
| Apparence | Poudre blanche, presque blanche ou beige à rose |
| Vancomycine B | TNL 85 % |
| Limite de monodéchlorovancomycine | NMT 4,7 % |
| Dosage (base microbienne, anhydre) | NLT 900ug/mg |
1. L'incidence des infections communautaires à Staphylococcus aureus résistant à la méthicilline augmente à un rythme alarmant.Un traitement efficace a historiquement impliqué un débridement précoce et l'administration d'antibiotiques.Cette étude a été conçue pour déterminer de manière prospective l'efficacité de la thérapie empirique dans le traitement des infections des mains. Un essai prospectif randomisé a été mené dans un hôpital de comté de niveau I.Les patients avec une infection de la main ont reçu soit de la vancomycine intraveineuse empirique à l'admission, soit de la céfazoline intraveineuse.Les résultats ont été suivis en fonction de la gravité de l'infection, de la réponse clinique appropriée et de la durée du séjour.Le rapport coût-efficacité a été calculé en utilisant le coût total pour chaque patient dans les deux groupes.Des analyses statistiques ont été effectuées. Quarante-six patients ont été inclus dans l'étude.Vingt-quatre ont été randomisés pour la céfazoline (52,2 %) et 22 (47,8 %) pour la vancomycine.Il n'y avait pas de différence statistique entre le coût du traitement (p < 0,20) ou la durée moyenne de séjour (p < 0,18) entre les groupes.Les patients randomisés pour la céfazoline avaient des coûts moyens de traitement plus élevés que les patients randomisés pour la vancomycine (p < 0,05).Les patients atteints d'infections plus graves avaient des coûts moyens de traitement plus élevés (p < 0,0001) et une durée moyenne de séjour plus longue (p = 0,0002).Vers la fin de l'étude, l'incidence de S. aureus résistant à la méthicilline d'origine communautaire à l'hôpital du comté des auteurs s'est avérée être de 72 %, ce qui a entraîné l'arrêt prématuré de l'étude par le comité d'examen institutionnel en raison de l'incidence élevée. excluant toute autre randomisation. Le traitement précoce approprié pour S. aureus résistant à la méthicilline n'a pas été définitivement établi.Aucune différence de résultat entre la céfazoline et la vancomycine comme agent de première ligne n'a été identifiée.
2.Avec les améliorations de la cicatrisation des plaies grâce à l'utilisation d'antibiotiques prophylactiques intraveineux et de raffinements techniques, les infections postopératoires du coude sont devenues moins fréquentes mais se produisent encore dans certaines chirurgies électives du coude.L'objectif de cette étude était d'évaluer l'innocuité et l'efficacité de l'application prophylactique de vancomycine dans le site opératoire pour réduire l'incidence de l'infection après la libération ouverte de coudes raides post-traumatiques. Une revue rétrospective de 272 de ces patients au cours d'une période de 4 ans période a été réalisée.Dans le groupe témoin (93 patients), une prophylaxie simple avec des antibiotiques intraveineux standard a été réalisée ;dans le groupe vancomycine (179 patients), la poudre de vancomycine a été appliquée directement dans la plaie avant fermeture avec une prophylaxie intraveineuse standard. Après un suivi d'au moins 6 mois, le groupe témoin présentait 6 infections (6,45 % ; confiance intervalle : 2,40 % à 13,52 %) par rapport à aucun (0 % ; intervalle de confiance : 0 à 2 % 04 %) dans le groupe vancom ycine, ce qui représentait une différence statistiquement significative (P = 0,0027).Aucun effet indésirable n'a été documenté suite à l'utilisation directe de la poudre de vancomycine. L'application locale de poudre de vancomycine peut être un moyen prometteur de prévenir les infections postopératoires du coude après la libération du coude chez les patients présentant une raideur post-traumatique du coude.