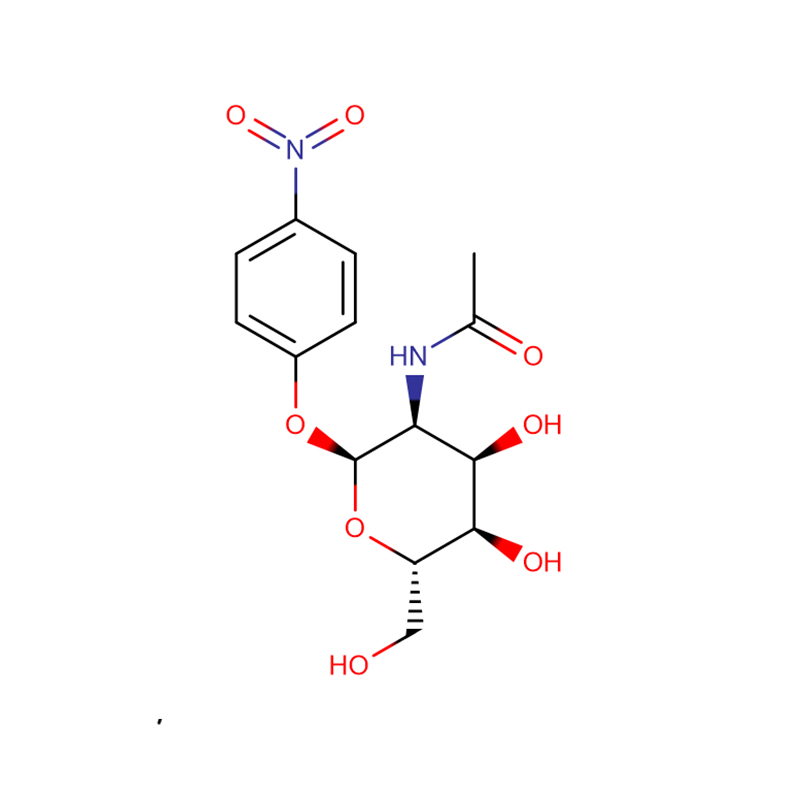
p-Nitrophenyl -aL-Fucopyranoside Cas:10231-84-2 Poudre cristalline blanche à jaune pâle
| Numéro de catalogue | XD90142 |
| Nom du produit | p-Nitrophényl -aL-Fucopyranoside |
| CAS | 10231-84-2 |
| Formule moléculaire | C12H15NO7 |
| Masse moléculaire | 285,25 |
| Détails de stockage | 2 à 8 °C |
| Code tarifaire harmonisé | 29400000 |
Spécification de produit
| Apparence | Poudre cristalline blanche à jaune pâle |
| Assay | 99% |
| CCM | Spot unique |
| CLHP de pureté | Au moins 98 % |
| Solubilité (1 % dans l'eau) | Solution claire et incolore |
| Densité | 1,503±0,06 g/cm3 (20 ºC 760 Torr), |
| Point de fusion | 196-197 ºC |
| Point d'ébullition | 515.4°Cat760mmHg |
| Point d'éclair | 265.5°C |
| Indice de réfraction | 1.623 |
LecA (PA-IL) est une lectine et une adhésine cytotoxiques produites par Pseudomonas aeruginosa qui lie les galactosides hydrophobes avec une spécificité et une affinité élevées.En utilisant une fusion de traduction lecA-egfp et une analyse immunoblot de la matrice extracellulaire du biofilm, nous montrons que lecA est exprimé dans les cellules cultivées en biofilm.Dans les essais de biofilm statiques sur le polystyrène et l'acier inoxydable, la profondeur et la couverture de surface du biofilm ont été réduites par la mutation de lecA et améliorées dans la souche PAO-P47 surproductrice de LecA.La couverture de la surface du biofilm par la souche parentale, PAO-P47, mais pas le mutant lecA sur des coupons en acier, a également été inhibée par la croissance en présence d'isopropyl-bêta-D-thiogalactoside (IPTG) ou de p-nitrophényl-alpha-D-galactoside ( NPG).De plus, les biofilms matures de type sauvage formés en l'absence de ces galactosides hydrophobes pourraient être dispersés par l'ajout d'IPTG.En revanche, l'ajout de p-nitrophényl-alpha-L-fucose (NPF) qui a une forte affinité pour la lectine P. aeruginosa LecB (PA-IIL) n'a eu aucun effet sur la formation ou la dispersion du biofilm.La croissance planctonique de P. aeruginosa PAO1 n'a pas été affectée par la présence d'IPTG, de NPG ou de NPF, et la souche n'a pas non plus été en mesure d'utiliser ces sucres comme sources de carbone, ce qui suggère que les effets observés sur la formation de biofilm étaient dus à l'inhibition compétitive du LecA-ligand obligatoire.Des résultats similaires ont également été obtenus pour les biofilms cultivés dans des conditions d'écoulement dynamique sur des coupons en acier, suggérant que LecA contribue à l'architecture du biofilm de P. aeruginosa dans différentes conditions environnementales.
Une alpha-L-fucosidase (EC 3.2.1.51) capable de libérer le résidu t-fucosyl de la chaîne latérale des oligosaccharides du xyloglucane a été détectée dans les feuilles des plantes Arabidopsis.De plus, une alpha-L-fucosidase avec une spécificité de substrat similaire a été purifiée à partir de feuilles de chou (Brassica oleracea) pour rendre une seule bande sur SDS-PAGE.Deux séquences peptidiques ont été obtenues à partir de cette bande protéique, et elles ont été utilisées pour identifier un gène d'Arabidopsis codant pour une alpha-fucosidase que nous proposons d'appeler AtFXG1.De plus, un gène d'Arabidopsis présentant une homologie avec des alpha-L-fucosidases connues a également été trouvé et nous avons proposé de le nommer AtFUC1.AtFXG1 et ATFUC1 étaient exprimés de manière hétérologue dans les cellules de Pichia pastoris et les activités alpha-L-fucosidase sécrétées dans le milieu de culture.L'alpha-L-fucosidase codée par AtFXG1 était active contre les oligosaccharides du xyloglucane XXFG ainsi que contre le 2'-fucosyl-lactitol mais pas contre le p-nitrophényl-alpha-L-fucopyranoside.Cependant, l'AtFUC1 exprimé de manière hétérologue n'était actif que contre le 2'-fucosyl-lactitol.Ainsi, le premier doit être lié au métabolisme du xyloglucane.