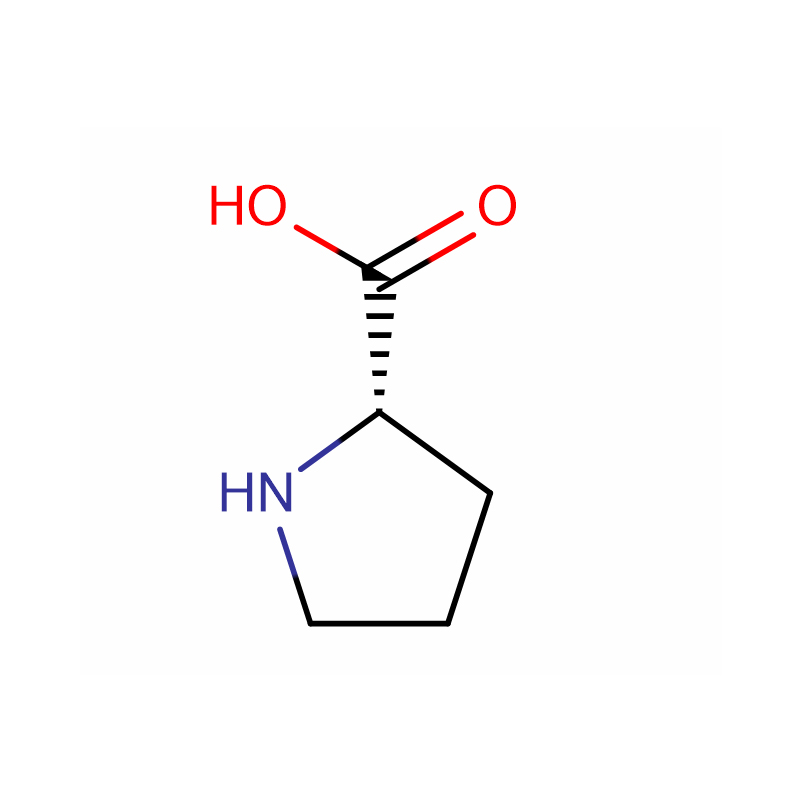
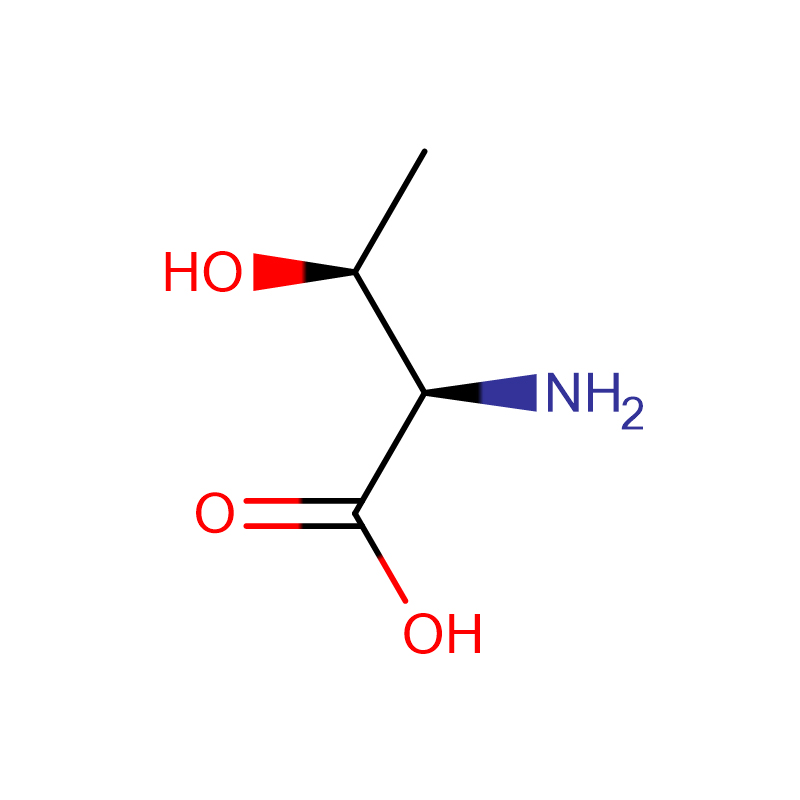
L-Proline Cas: 147-85-3 99% poudre blanche
| Numéro de catalogue | XD90293 |
| Nom du produit | L-Proline |
| CAS | 147-85-3 |
| Formule moléculaire | C5H9NO2 |
| Masse moléculaire | 115.13046 |
| Détails de stockage | Ambiant |
| Code tarifaire harmonisé | 29339980 |
Spécification de produit
| Essai | 99 % min |
| Apparence | poudre blanche |
| Rotation spécifique | -84,5 à -86 |
| Métaux lourds | <15 ppm |
| AS | <1 ppm |
| Ph | 5.9 - 6.9 |
| SO4 | <0,050 % |
| Fe | <30ppm |
| Perte au séchage | <0,3 % |
| Résidu à l'allumage | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,050 % |
| État de solution | >98% |
Comprendre le métabolisme de l'hôte microbien est essentiel pour le développement et l'optimisation des processus biocatalytiques à base de cellules entières, car il dicte l'efficacité de la production.Cela est particulièrement vrai pour la biocatalyse redox où des cellules métaboliquement actives sont employées en raison de la capacité de régénération du cofacteur/cosubstrat endogène chez l'hôte.Escherichia coli recombinant a été utilisé pour surproduire de la proline-4-hydroxylase (P4H), une dioxygénase catalysant l'hydroxylation de la L-proline libre en trans-4-hydroxy-L-proline avec l'a-cétoglutarate (a-KG) comme cosubstrat.Dans ce biocatalyseur à cellules entières, le métabolisme central du carbone fournit le cosubstrat a-KG requis, couplant directement les performances biocatalytiques du P4H au métabolisme du carbone et à l'activité métabolique.En appliquant à la fois des outils de biologie expérimentale et computationnelle, tels que l'ingénierie métabolique et l'analyse des flux métaboliques (13) C ((13) C-MFA), nous avons étudié et décrit quantitativement la réponse physiologique, métabolique et bioénergétique du biocatalyseur de cellules entières. à la bioconversion ciblée et identifié les goulots d'étranglement métaboliques possibles pour une ingénierie plus rationnelle des voies. Une souche d'E. coli déficiente en dégradation de la proline a été construite en supprimant le gène putA codant pour la proline déshydrogénase.Les biotransformations de cellules entières avec cette souche mutante ont conduit non seulement à une hydroxylation quantitative de la proline, mais également à un doublement du taux de formation spécifique de trans-4-L-hydroxyproline (hyp), par rapport au type sauvage.L'analyse du flux de carbone à travers le métabolisme central de la souche mutante a révélé que la demande accrue d'a-KG pour l'activité P4H n'améliorait pas le flux de production d'a-KG, indiquant un fonctionnement du cycle TCA étroitement régulé dans les conditions étudiées.Dans la souche de type sauvage, la synthèse et la catalyse de P4H ont provoqué une réduction du rendement en biomasse.Fait intéressant, la souche ΔputA a en outre compensé la perte d'ATP et de NADH associée en réduisant les besoins énergétiques d'entretien à des taux d'absorption de glucose relativement faibles, au lieu d'augmenter l'activité du TCA. être prometteur pour la catalyse P4H productive non seulement en termes de rendement de biotransformation, mais également en ce qui concerne les taux de biotransformation et d'absorption de proline et le rendement de hyp sur la source d'énergie.Les résultats indiquent que, lors d'un knock-out de putA, le couplage du cycle TCA à l'hydroxylation de la proline via le cosubstrat a-KG devient un facteur clé contraignant et une cible pour améliorer encore l'efficacité des biotransformations dépendantes de l'a-KG.