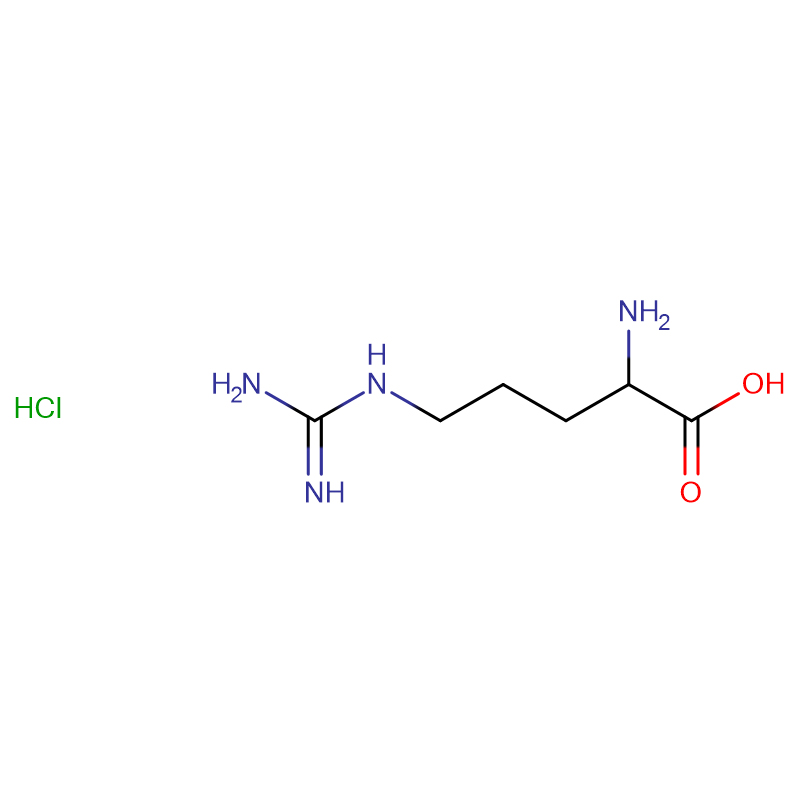
L-Arginine CAS : 74-79-3 99 % de cristaux blancs ou de poudre cristalline
| Numéro de catalogue | XD90323 |
| Nom du produit | L-Arginine |
| CAS | 74-79-3 |
| Formule moléculaire | C6H14N4O2 |
| Masse moléculaire | 174,20 |
| Détails de stockage | Ambiant |
| Code tarifaire harmonisé | 29252900 |
Spécification de produit
| Apparence | Cristaux blancs ou poudre cristalline |
| Essai | 99% |
| Identification | Absorption infrarouge |
| Perte au séchage | ≤ 0,5 % |
| Pureté chromatographique | Pas plus de 0,5 % de toute impureté individuelle est trouvée ; Pas plus de 2,0 % des impuretés totales sont trouvées |
| Résidu à l'allumage | ≤ 0,3 % |
| Métaux lourds (PB) | ≤ 0,0015 % |
| Fer (comme Fe) | ≤ 0,003 % |
| Sulfate (comme SO4) | ≤ 0,03 % |
| Qualité Usp | USP 33 |
| Chlorure (CI) | ≤ 0,05 % |
| Rotation spécifique [ α ] D 2 5 | +26,3 ° ~ +27,7 ° |
Le mécanisme de Mycobacterium smegmatis G (MbsG), une l-lysine monooxygénase dépendante de la flavine, a été étudié dans des conditions de réaction stable et rapide en utilisant des effets isotopiques cinétiques primaires et de solvant, des analogues de substrat, des effets de pH et de viscosité de solvant comme sondes mécanistes.Les résultats suggèrent que la l-lysine se lie avant le NAD(P)H, ce qui entraîne une diminution de la constante de vitesse pour la réduction de la flavine.La liaison de la l-lysine n'a aucun effet sur la vitesse d'oxydation de la flavine, qui se produit dans un processus en une étape sans l'observation d'un intermédiaire C4a-hydroperoxyflavine.Des effets similaires ont été déterminés avec plusieurs analogues de substrat.L'oxydation de la flavine est indépendante du pH, tandis que les profils de pH kcat/Km et kred/KD pour le NAD(P)H présentent des valeurs uniques de pKa d'environ 6,0, avec une activité croissante à mesure que le pH diminue.À un pH plus bas, l'enzyme devient plus découplée, produisant plus de peroxyde d'hydrogène et de superoxyde.Le transfert d'hydrure est partiellement limitant à pH neutre et devient plus limitant à faible pH.Un effet inverse de la viscosité du solvant sur kcat/Km pour le NAD(P)H a été observé à pH neutre alors qu'un effet normal de la viscosité du solvant a été observé à un pH inférieur.Ensemble, les résultats indiquent un mécanisme unique où un changement de conformation limitant la vitesse et sensible au pH se produit dans la demi-réaction réductrice, ce qui affecte l'efficacité de l'hydroxylation de la lysine.