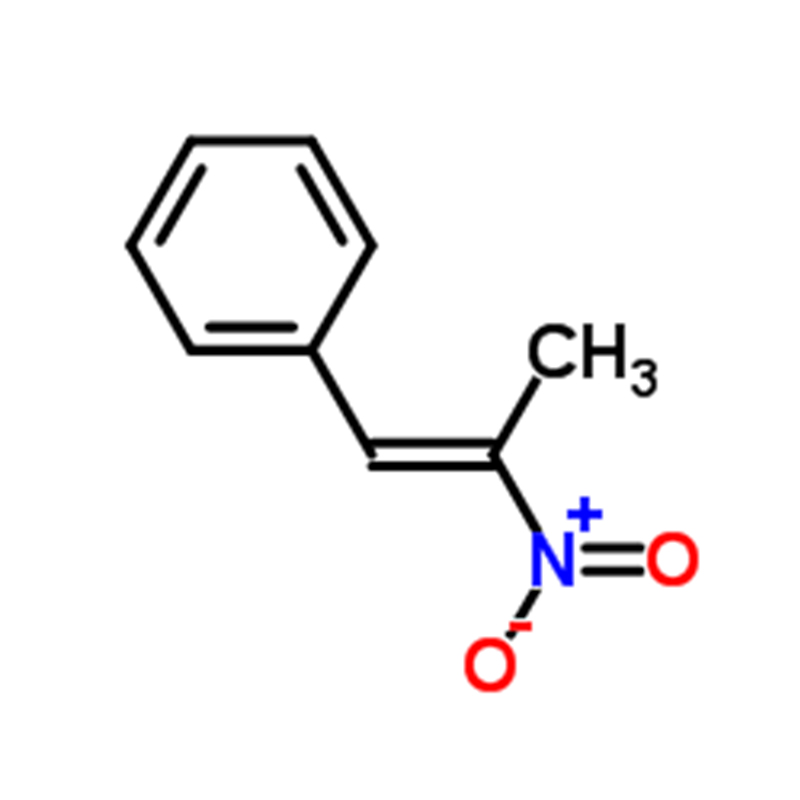
Jaune de diméthyl CAS: 60-11-7 Poudre jaune à orange à brune
| Numéro de catalogue | XD90467 |
| Nom du produit | Jaune de diméthyle |
| CAS | 60-11-7 |
| Formule moléculaire | C14H15N3 |
| Masse moléculaire | 225-29 |
| Détails de stockage | Ambiant |
| Code tarifaire harmonisé | 29270000 |
Spécification de produit
| Point de fusion | 105-116 degrés Celsius |
| Apparence | Poudre jaune à orange à brune |
| Essai | 99% |
| Perte au séchage | <1,0 % |
| Force | 98,67 % |
| Changement de couleur | Rouge à pH 2,9, Jaune à pH 4,9 |
| Cendres sulfatées | 0,4 % |
| LamdaMax | 400nm (dans le méthanol) |
La topologie membranaire du domaine du canal E1 de la colicine a été étudiée par transfert d'énergie par résonance de fluorescence (FRET).Le FRET impliquait un acide aminé fluorescent génétiquement codé (coumarine) en tant que donneur et un résidu de cystéine sélectivement marqué attaché avec du DABMI (4-(diméthylamino)phénylazophényl-4'-maléimide) en tant qu'accepteur de FRET.Le résidu de coumarine fluorescent a été incorporé dans la protéine via une paire orthogonale ARNt/aminoacyl-ARNt synthétase qui a permis une incorporation sélective dans n'importe quel site du domaine du canal de la colicine.Chaque variante hébergeait une mutation stop (TAG) pour l'incorporation de la coumarine et une mutation de la cystéine (TGT) pour la fixation du DABMI.Six distances interhélicoïdales dans les hélices 1 à 6 ont été déterminées à l'aide de l'analyse FRET pour les états soluble et lié à la membrane.Les données FRET ont montré d'importants changements dans les distances interhélicoïdales entre les hélices 3 à 6 lors de l'association membranaire, fournissant un nouvel aperçu de la structure liée à la membrane du domaine du canal.En général, les efficacités interhélicoïdales de la coumarine-DABMI FRET ont diminué lors de la liaison à la membrane, en s'appuyant sur le modèle parapluie pour le canal de la colicine.Un modèle provisoire pour l'état fermé du domaine du canal a été développé sur la base des données FRET actuelles et publiées précédemment.Le modèle suggère une disposition circulaire des hélices 1 à 7 dans le sens des aiguilles d'une montre à partir du côté extracellulaire et une association interfaciale membranaire des hélices 1, 6, 7 et 10 autour de l'épingle à cheveux transmembranaire centrale formée par les hélices 8 et 9.



![3,3′,5,5′-Tétraméthyl-[1,1'-biphényl]-4,4′-diamine Cas:54827-17-7 99%](http://cdn.globalso.com/xdbiochems/54827-17-71.jpg)