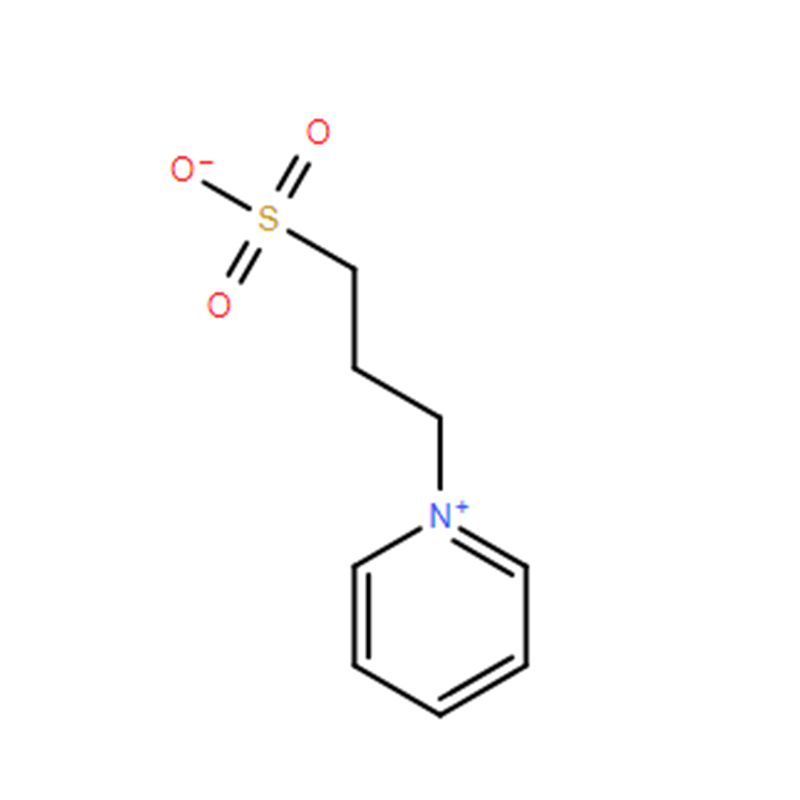
3-(1-pyridinio)-1-propanesulfonate Cas : 15471-17-7 99 % Poudre blanche
| Numéro de catalogue | XD90192 |
| Nom du produit | 3-(1-pyridinio)-1-propanesulfonate |
| CAS | 15471-17-7 |
| Formule moléculaire | C8H11NO3S |
| Masse moléculaire | 201.24 |
| Détails de stockage | 0 à 8°C |
| Code tarifaire harmonisé | 29333990 |
Spécification de produit
| Apparence | poudre blanche |
| Essai | 99% |
La phosphorylation des protéines régule diverses fonctions cellulaires et joue un rôle clé dans le développement précoce des plantes.Pour compléter et développer les enquêtes précédentes sur la phosphorylation des protéines dans les semis d'Arabidopsis, nous avons utilisé une approche alternative qui combine l'extraction des protéines dans des conditions non dénaturantes avec l'enrichissement par chromatographie d'affinité sur ions métalliques immobilisés (IMAC) de phosphoprotéines intactes dans des extraits appauvris en Rubisco, suivi d'une identification. en utilisant l'électrophorèse sur gel bidimensionnelle (2-DE) et la chromatographie liquide-spectrométrie de masse en tandem (LC-MS/MS).La digestion de la trypsine dans le gel et l'analyse de points de gel sélectionnés ont identifié 144 peptides et résidus phosphorylés, dont seulement 18 phosphopeptides et 8 phosphosites ont été trouvés dans les bases de données de sites de phosphorylation PhosPhAt 4.0 et P3DB d'Arabidopsis thaliana.Plus de la moitié des 82 phosphoprotéines identifiées étaient impliquées dans le métabolisme des glucides, la photosynthèse/respiration ou les mécanismes de réponse au stress oxydatif.L'enrichissement des phosphoprotéines intactes avant 2-DE et LC-MS/MS semble améliorer la détection des résidus phosphorylés de thréonine et de tyrosine par rapport aux méthodes qui utilisent l'enrichissement au niveau des peptides, ce qui suggère que les deux approches sont quelque peu complémentaires en termes de couverture du site de phosphorylation.La comparaison des résultats pour les jeunes semis avec ceux obtenus précédemment pour les feuilles matures d'Arabidopsis a identifié cinq protéines qui sont différentiellement phosphorylées dans ces tissus, démontrant le potentiel de cette technique pour étudier la dynamique de la phosphorylation des protéines au cours du développement de la plante.