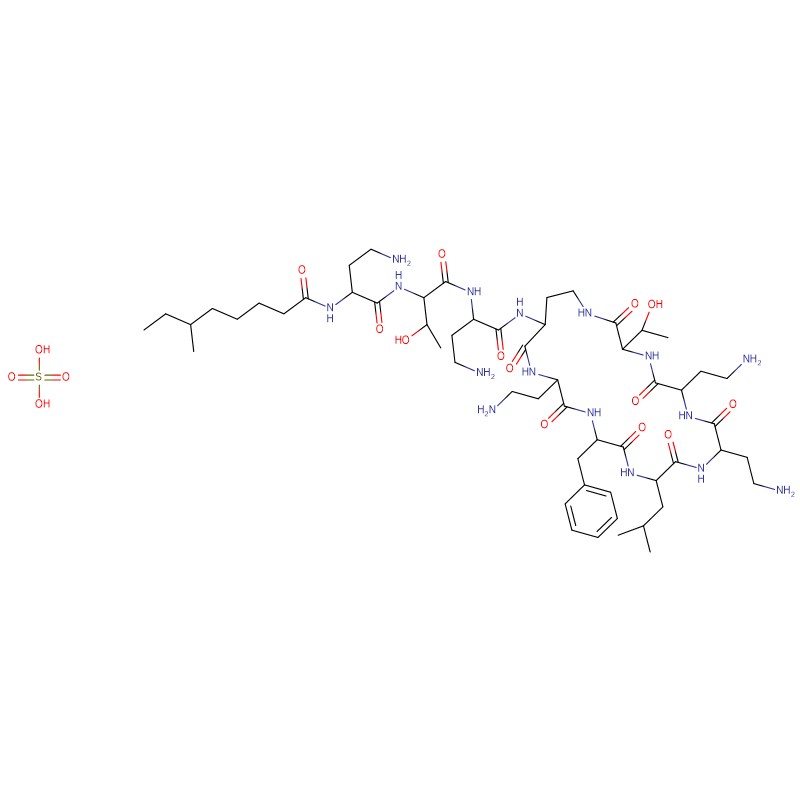
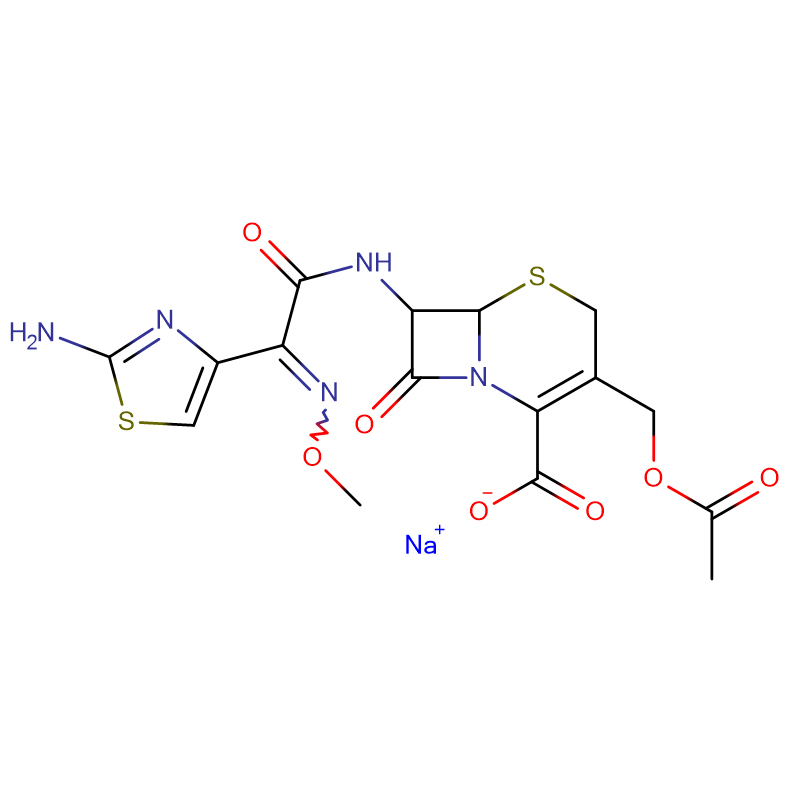
Sulfate de polymyxine B CAS: 1405-20-5 Poudre blanche
| Numéro de catalogue | XD90360 |
| Nom du produit | Sulfate de polymyxine B |
| CAS | 1405-20-5 |
| Formule moléculaire | C55H96N16O13 · 2H2SO4 |
| Masse moléculaire | 1385.61 |
| Détails de stockage | 2 à 8 °C |
| Code tarifaire harmonisé | 29419000 |
Spécification de produit
| Conclusion | Conforme à USP35 |
| Métaux lourds | <20ppm |
| pH | 5-7 |
| Identification | Chromatographie liquide : conforme |
| Essai | 99% |
| Apparence | poudre blanche |
| Perte au séchage | <6 % |
| Solubilité | Facilement soluble dans l'eau, légèrement soluble dans l'éthanol |
| Sulfate | 15,5 % - 17,5 % |
| La taille des particules | <30µm |
| Une rotation optique spécifique | -78° -90° |
| Phénylalanine | 9.0%-12.0% |
| Pyrogènes | Répond aux exigeances |
| Cendres sulfatées | <0,75 % |
| Nombre total d'aérobies viables | <100 ufc/g |
| Puissance | >6500 UI/mg |
L'organelle de sécrétion de protéines ExPortal chez Streptococcus pyogenes est un microdomaine membranaire anionique contenant des phospholipides enrichi en translocons Sec et en facteurs de biogenèse protéique post-sécrétion.La polymyxine B se lie et perturbe l'intégrité d'ExPortal, entraînant une sécrétion défectueuse de plusieurs toxines.Pour mieux comprendre les facteurs qui influencent l'organisation d'ExPortal, un criblage génétique a été effectué pour sélectionner des mutants spontanés résistants à la polymyxine B affichant une intégrité ExPortal améliorée.Le reséquençage du génome entier de 25 mutants résistants a révélé de une à quatre mutations par génome mutant regroupés principalement dans un ensemble de base de 10 groupes de gènes.La construction de mutants avec des délétions ou des insertions individuelles a démontré que 7 gènes centraux confèrent une résistance et une intégrité améliorée d'ExPortal par la perte de fonction, tandis que 3 étaient probablement dus à un gain de fonction et/ou à des effets combinatoires.Les gènes de résistance de base comprennent un régulateur transcriptionnel de la biosynthèse des lipides, plusieurs gènes impliqués dans l'acquisition des nutriments et une variété de gènes impliqués dans les réponses au stress.Deux membres de cette dernière classe fonctionnent également comme de nouveaux régulateurs de la protéase à cystéine SpeB sécrétée.L'analyse de la mutation la plus fréquemment isolée, une délétion d'un seul nucléotide dans une piste de 9 résidus d'adénine consécutifs dans pstS, codant pour un composant d'un transporteur Pi de haute affinité, suggère que cette séquence fonctionne comme un interrupteur moléculaire pour faciliter l'adaptation au stress.Ensemble, ces données suggèrent l'existence d'une réponse au stress membranaire qui favorise l'intégrité d'ExPortal et la résistance aux peptides antimicrobiens cationiques.