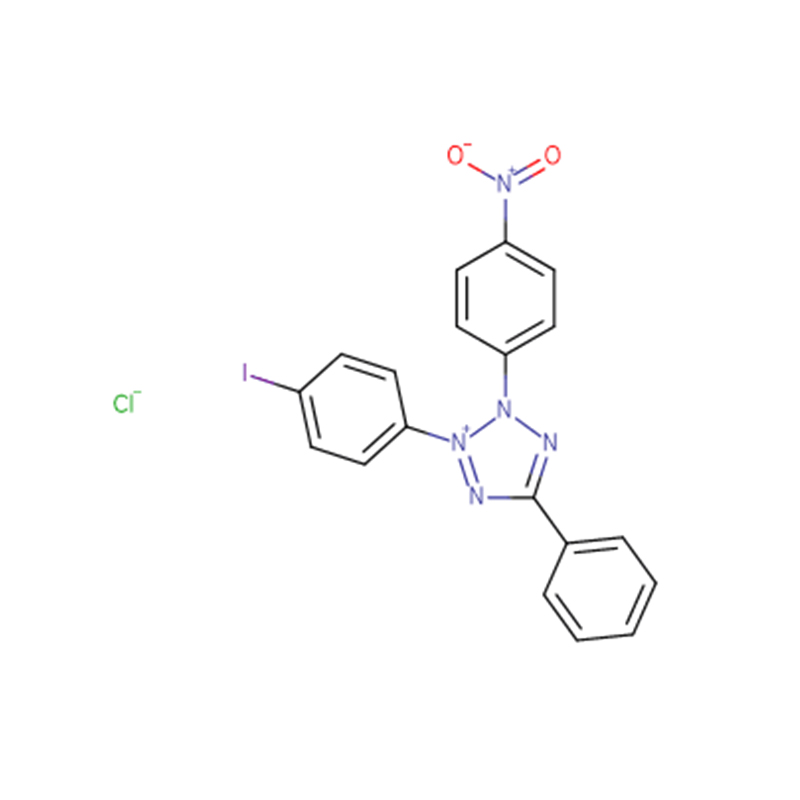
Chlorure d'iodonitrotétrazolium Cas: 146-68-9 98% Poudre jaune clair à orange
| Numéro de catalogue | XD90217 |
| Nom du produit | Chlorure d'iodonitrotétrazolium |
| CAS | 146-68-9 |
| Formule moléculaire | C19H13ClIN5O2 |
| Masse moléculaire | 505,70 |
| Détails de stockage | 2 à 8 °C |
| Code tarifaire harmonisé | 32129000 |
Spécification de produit
| Identification | H-RMN |
| Solubilité | Solution claire |
| Apparence | Poudre jaune clair à orange |
| CLHP de dosage | >98% |
Une translocation réciproque du gène ABL1 vers le gène BCR entraîne l'expression de la protéine de fusion oncogène BCR-ABL1, qui caractérise la leucémie myéloïde chronique (LMC) humaine, une maladie myéloproliférative considérée comme invariablement mortelle jusqu'à l'introduction de la famille imatinib de la tyrosine kinase inhibiteurs (ITK).Néanmoins, l'insensibilité des cellules souches de la LMC au traitement par ITK et la résistance intrinsèque ou acquise sont encore des causes fréquentes de persistance de la maladie et de progression de la phase blastique chez les patients après des thérapies initiales réussies.Ici, nous avons étudié un rôle possible pour la kinase MAPK15/ERK8 dans l'autophagie dépendante de BCR-ABL1, un processus clé pour la leucémogenèse induite par l'oncogène.Dans ce contexte, nous avons montré la capacité de MAPK15 à recruter physiquement l'oncogène dans les vésicules autophagiques, confirmant notre hypothèse d'un rôle biologiquement pertinent pour cette MAP kinase dans la transduction du signal par cet oncogène.En effet, en modélisant la signalisation BCR-ABL1 dans les cellules HeLa et en tirant parti d'un modèle physiologiquement pertinent pour la LMC humaine, à savoir les cellules K562, nous avons démontré que l'autophagie induite par BCR-ABL1 est médiée par MAPK15 grâce à sa capacité à interagir avec la famille LC3. protéines, de manière dépendante du LIR.De manière intéressante, nous avons également pu interférer avec l'autophagie induite par BCR-ABL1 par une approche pharmacologique visant à inhiber MAPK15, ouvrant la possibilité d'agir sur cette kinase pour affecter l'autophagie et les maladies dépendant de cette fonction cellulaire.En effet, pour soutenir la faisabilité de cette approche, nous avons démontré que l'épuisement de l'expression endogène de MAPK15 inhibait la prolifération cellulaire dépendante de BCR-ABL1, in vitro, et la formation de tumeurs, in vivo, fournissant ainsi un nouveau lien « médicamenteux » entre BCR-ABL1 et LMC humaine.