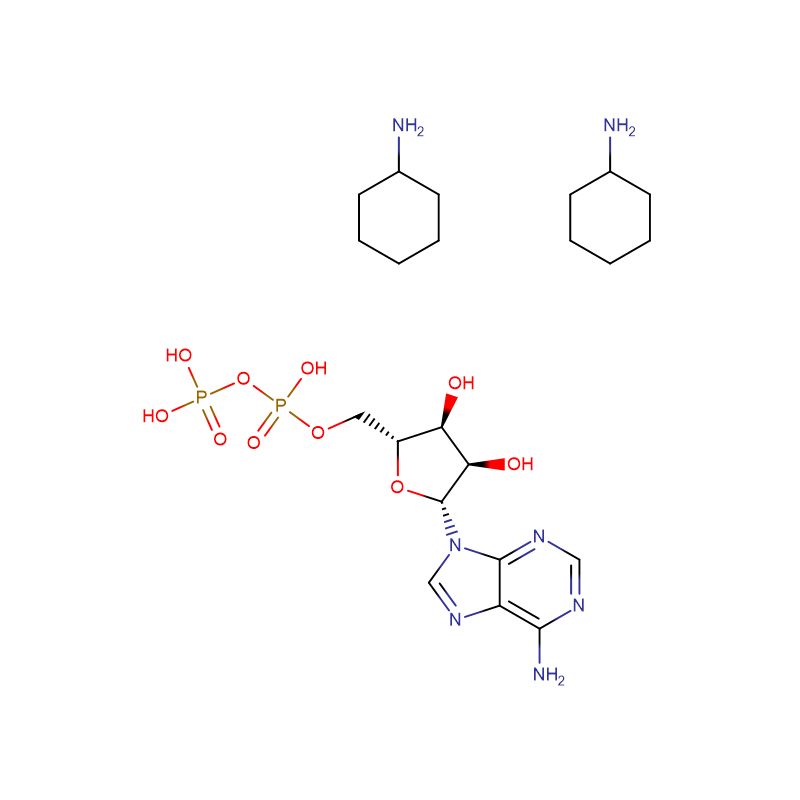
adénosine 5′-diphosphate di(monocyclohexylammoniu Cas : 102029-87-8 99 % poudre blanche
| Numéro de catalogue | XD90159 |
| Nom du produit | adénosine 5'-diphosphate di(monocyclohexylammoniu |
| CAS | 102029-87-8 |
| Formule moléculaire | C10H15N5O10P2·2C6H13N |
| Masse moléculaire | 625,55 |
| Détails de stockage | 2 à 8 °C |
| Code tarifaire harmonisé |
Spécification de produit
| Apparence | poudre blanche |
| Assay | 99% |
1. Pour étudier si l'adénosine dérivée de l'adénosine diphosphate (ADP) pourrait inhiber l'agrégation plaquettaire, en particulier en présence d'un antagoniste P2Y₁₂, où les effets de l'ADP sur le récepteur P2Y₁₂ seraient empêchés. L'agrégation plaquettaire a été mesurée en réponse à l'activateur du récepteur de la thrombine peptide par numération plaquettaire dans le plasma riche en plaquettes (PRP) et le sang total en présence d'ADP et des antagonistes P2Y₁₂ cangrelor, métabolite actif du prasugrel et ticagrelor.En présence d'un antagoniste P2Y₁₂, la préincubation du PRP avec l'ADP inhibe l'agrégation ;cet effet a été aboli par l'adénosine désaminase.Aucune inhibition de l'agrégation ne s'est produite dans le sang total, sauf lorsque du dipyridamole a été ajouté pour inhiber l'absorption d'adénosine dans les érythrocytes.Les effets de l'ADP dans le PRP et le sang total ont été reproduits à l'aide d'adénosine et étaient directement liés aux modifications de l'AMPc (évaluées par la phosphorylation de la phosphoprotéine stimulée par un vasodilatateur).Tous les résultats étaient les mêmes quel que soit l'agoniste P2Y₁₂ utilisé. L'ADP inhibe l'agrégation plaquettaire en présence d'un antagoniste P2Y₁₂ par conversion en adénosine.L'inhibition se produit dans le PRP mais pas dans le sang total, sauf lorsque l'absorption d'adénosine est inhibée.Aucun des antagonistes P2Y₁₂ étudiés n'a reproduit les effets du dipyridamole dans les expériences qui ont été réalisées.
2. L'ADP est considéré comme un agoniste plaquettaire faible en raison des réponses d'agrégation limitées qu'il induit in vitro à des concentrations physiologiques de Ca(2+) extracellulaire [(Ca(2+) )(o)].Abaisser [Ca(2+) ](o) améliore paradoxalement l'agrégation évoquée par l'ADP, un effet qui a été attribué à la production accrue de thromboxane A(2).Cette étude a examiné le rôle des ectonucléotidases dans la [Ca(2+) ](o) -dépendance de l'activation plaquettaire.La réduction [Ca(2+)](o) des niveaux millimolaires aux niveaux micromolaires a converti l'agrégation plaquettaire évoquée par l'ADP (10 μmol/l) d'une réponse transitoire à une réponse soutenue dans le plasma riche en plaquettes et les suspensions lavées.Le blocage de la production de thromboxane A(2) avec de l'aspirine n'a eu aucun effet sur cette [Ca(2+) ](o) -dépendance.La prévention de la dégradation de l'ADP a aboli les différences entre les faibles et physiologiques [Ca(2+) ](o) résultant en une agrégation robuste et soutenue dans les deux conditions.Les mesures de l'ADP extracellulaire ont révélé une dégradation réduite dans le plasma et la solution saline contenant de l'apyrase à micromolaire par rapport à millimolaire [Ca(2+)](o) .Comme indiqué précédemment, la génération de thromboxane A(2) a été améliorée à faible [Ca(2+)](o), mais cela était indépendant de l'activité de l'ectonucléotidase(.) Les antagonistes des récepteurs P2Y cangrelor et MRS2179 ont démontré la nécessité des récepteurs P2Y(12) pour l'agrégation soutenue évoquée par ADP, avec un rôle mineur pour P2Y(1) .En conclusion, l'activité ectonucléotidase Ca(2+)-dépendante est un facteur majeur déterminant l'étendue de l'agrégation plaquettaire à l'ADP et doit être contrôlée dans les études d'activation des récepteurs P2Y.