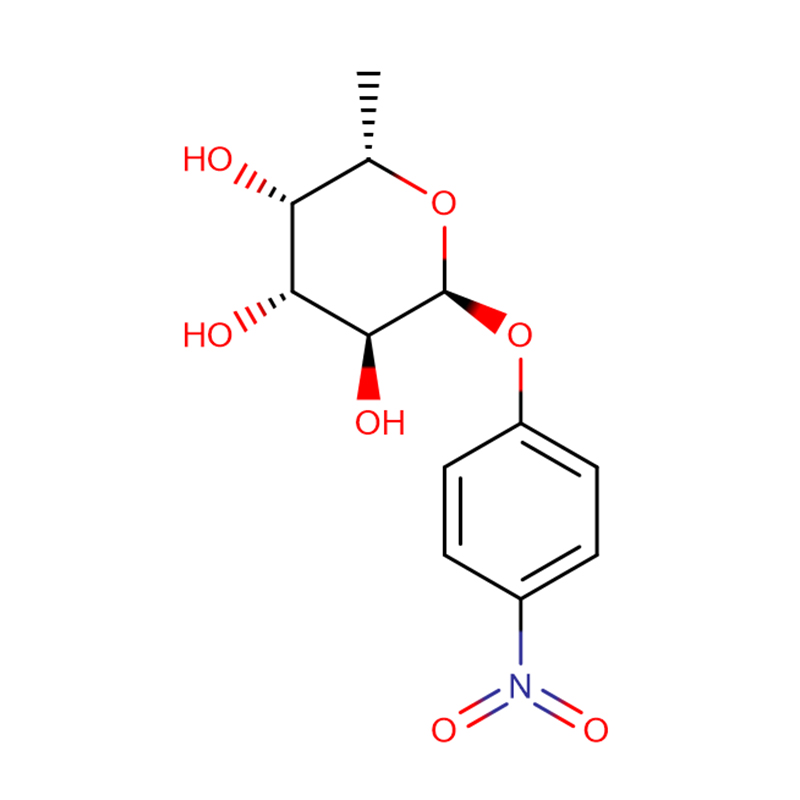
4-Nitrophenyl-alpha-L-fucopyranoside CAS: 10231-84-2 Poudre cristalline blanche à jaune pâle
| Numéro de catalogue | XD90253 |
| Nom du produit | 4-nitrophényl-alpha-L-fucopyranoside |
| CAS | 10231-84-2 |
| Formule moléculaire | C12H15NO7 |
| Masse moléculaire | 285,25 |
| Détails de stockage | 2 à 8 °C |
| Code tarifaire harmonisé | 29400000 |
Spécification de produit
| Solubilité | Solution claire et incolore |
| Essai | 99% |
| Apparence | Poudre cristalline blanche à jaune pâle |
| CCM | Spot unique |
| CLHP de pureté | Au moins 98 % |
La manière dont les effets de mutations simultanées se combinent pour modifier l'activité enzymatique n'est pas facilement prévisible car ces effets ne s'additionnent pas toujours de manière linéaire.Par conséquent, la caractérisation des effets de mutations simultanées de résidus d'acides aminés qui se lient au substrat peut apporter une contribution significative à la compréhension de la spécificité de substrat des enzymes.Dans la bêta-glycosidase de Spodoptera frugiperda (Sfbetagly), les deux résidus Q39 et E451 interagissent avec le substrat, ce qui est essentiel pour définir la spécificité du substrat.Des doubles mutants de Sfbetagly (A451E39, S451E39 et S451N39) ont été préparés par mutagenèse dirigée, exprimés dans des bactéries et purifiés par chromatographie d'affinité.Ces enzymes ont été caractérisées en utilisant le p-nitrophényl bêta-galactoside et le p-nitrophényl bêta-fucoside comme substrats.Le rapport k cat/Km pour les mutants simples et doubles de Sfbetagly contenant des mutations dirigées sur le site aux positions Q39 et E451 a été utilisé pour démontrer que l'effet sur l'énergie libre de ESdouble dagger (enzyme-transition state complex) des doubles mutations (Gdouble daggerxy) n'est pas la somme des effets résultant des mutations simples (Gdouble daggerx et Gdouble daggery).Cette différence dans Gdouble dagger indique que les effets des mutations simples se chevauchent partiellement.Par conséquent, cet effet commun ne compte qu'une seule fois dans Gdouble daggerxy.Les données cristallographiques sur les bêta-glycosidases révèlent la présence d'une liaison hydrogène bidentée impliquant les résidus Q39 et E451 et le même groupe hydroxyle du substrat.Par conséquent, les données thermodynamiques et cristallographiques suggèrent que les résidus Q39 et E451 exercent une influence mutuelle sur leurs interactions respectives avec le substrat.