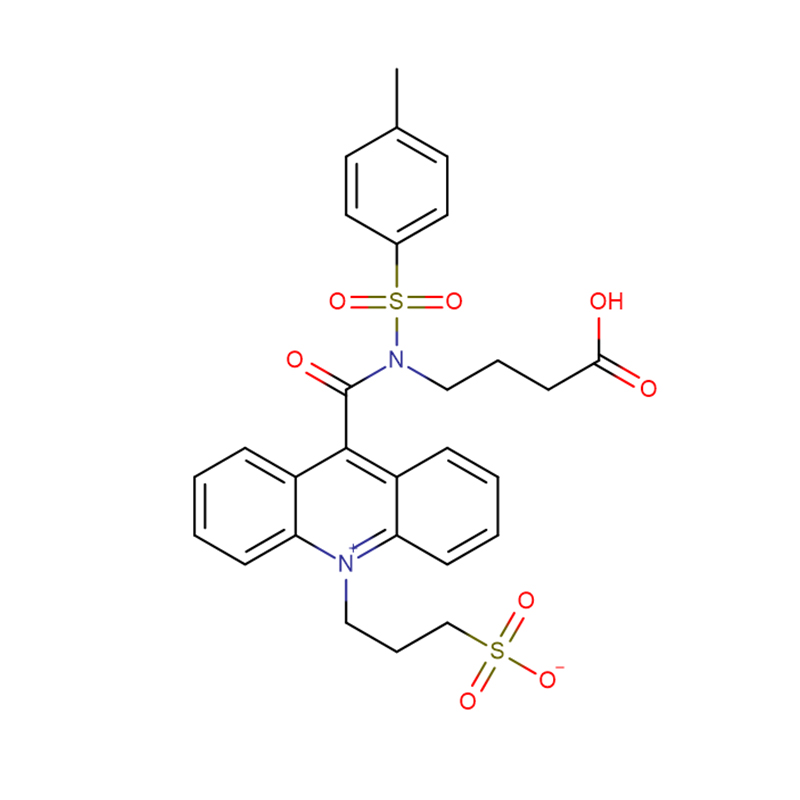
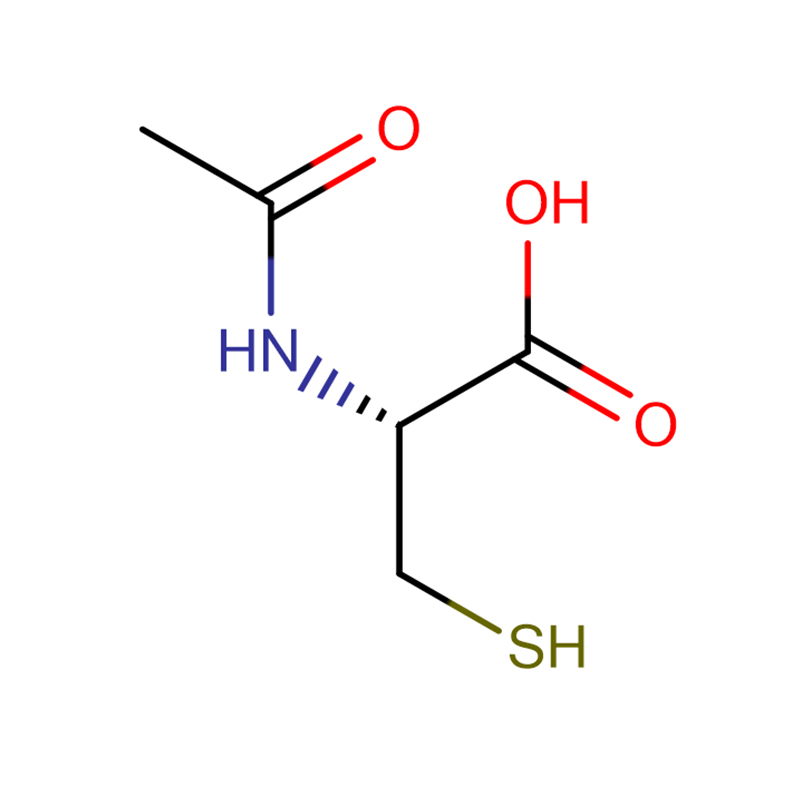
4-Amino-3-hydrazino-1,2,4-triazol-5-thiol Cas:28836-03-5 99% Solide jaune à vert
| Numéro de catalogue | XD90146 |
| Nom du produit | 4-Amino-3-hydrazino-1,2,4-triazol-5-thiol |
| CAS | 28836-03-5 |
| Formule moléculaire | C16H13NO3S·NH3 |
| Masse moléculaire | 316,37 |
| Détails de stockage | Ambiant |
| Code tarifaire harmonisé | 2923900090 |
Spécification de produit
| Apparence | Solide jaune à vert |
| Assay | ≥ 99% |
| Point de fusion | 237°C(déc.)(lit.) |
| Solubilité | NaOH : soluble1 N |
| Soluble dans l'eau | Soluble dans l'eau, NaOH 1N et méthanol. |
1.Nous avons étudié les effets inhibiteurs de l'isorhamnétine sur la tyrosinase de champignon par cinétique d'inhibition et simulation informatique.L'isorhamnétine a inhibé de manière réversible la tyrosinase de manière mixte à Ki = 0,235 ± 0,013 mM.Les mesures de fluorescence intrinsèque et de liaison au 1-anilinonaphthalène-8-sulfonate (ANS) ont montré que l'isorhamnétine n'induisait pas de changements significatifs dans la structure tertiaire de la tyrosinase.Pour mieux comprendre le processus d'inactivation, la cinétique a été calculée via des mesures d'intervalle de temps et des réactions de substrat continues.Les résultats ont indiqué que l'inactivation induite par l'isorhamnétine était une réaction de premier ordre avec des processus biphasiques.Pour mieux comprendre, nous avons simulé l'amarrage entre la tyrosinase et l'isorhamnetin.La simulation a réussi (énergies de liaison pour Dock6.3 : -32,58 kcal/mol, pour AutoDock4.2 : -5,66 kcal/mol et pour Fred2.2 : -48,86 kcal/mol), suggérant que l'isorhamnetin interagit avec plusieurs résidus, tels que comme HIS244 et MET280.Cette stratégie de prédiction de l'interaction de la tyrosinase en combinaison avec une cinétique basée sur un composé flavanone pourrait s'avérer utile dans le criblage d'inhibiteurs naturels potentiels de la tyrosinase.
2. La voie de dépliement acide de la conalbumine (CA), une glycoprotéine monomère du blanc d'œuf de poule, a été étudiée à l'aide de la spectroscopie CD UV lointaine et proche, de l'émission de fluorescence intrinsèque, de la sonde de fluorescence extrinsèque 1-anilino-8-naphtalène sulfonate (ANS) et la diffusion dynamique de la lumière (DLS).Nous observons des changements dépendant du pH dans la structure secondaire et tertiaire de CA.Il a une structure secondaire α-hélicoïdale de type natif à pH 4,0 mais une structure de perte à pH 3,0.Le CA existait exclusivement sous la forme d'un état de globule pré-fondu et d'un état de globule fondu en solution à pH 4,0 et pH 3,0, respectivement.L'effet du pH sur la conformation et la thermostabilité de l'AC indique sa résistance à la chaleur à pH neutre.Les résultats DLS montrent que l'état MG existait sous forme compacte dans des solutions aqueuses avec des rayons hydrodynamiques de 4,7 nm.L'extinction de la fluorescence du tryptophane par l'acrylamide a en outre confirmé l'accumulation d'un état intermédiaire, partiellement déplié, entre les états natif et déplié.


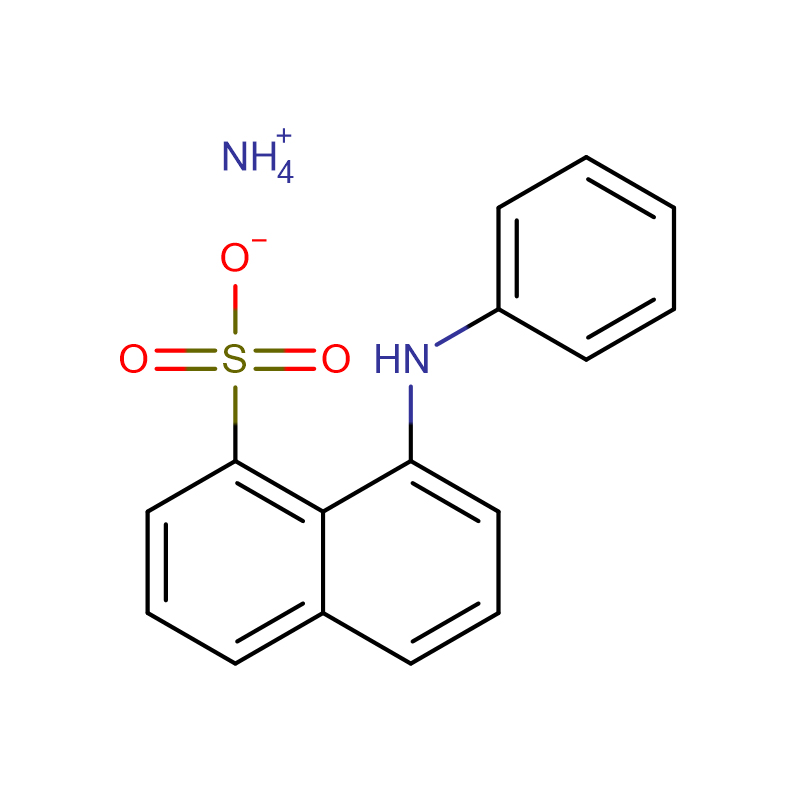


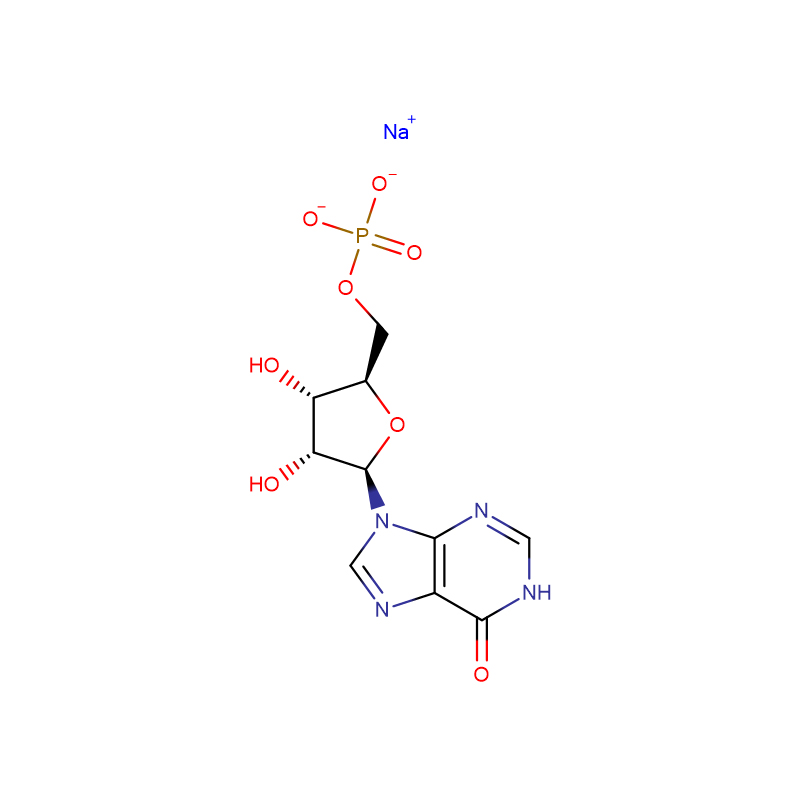
![Sel de sodium de la N-[[bis[4-(diméthylamino)phényl]amino]carbonyl]glycine Poudre cristalline blanche à gris-vert](http://cdn.globalso.com/xdbiochems/115871-19-7.jpg)